Blog do Enem: simplificado como deve ser |
- Física: curso, profissão e mercado de trabalho
- Ciências Atuariais: curso, profissão e mercado de trabalho
- Fórmula Empírica e Molecular. Química Enem e Vestibular: Confira.
- Transporte através da Membrana Plasmática- Biologia Celular Enem e vestibular
- Química: Revisão de Cálculo Estequiométrico para vestibular e Enem
| Física: curso, profissão e mercado de trabalho Posted: 08 Dec 2015 05:35 PM PST Profissão: Sempre adorou as aulas de Física na escola? Já quis continuar esses estudos em um nível de graduação? Saiba tudo sobre o curso, a carreira e o mercado de trabalho do físico!O que é Física?Você deve se lembrar das aulas da escola: a Física é a ciência que estuda as relações entre matéria e energia, as leis que regem essa relação e suas propriedades. Como a matéria e a energia estão em todos os lugares, pode-se dizer que Física é o estudo do mundo inteiro: desde o menor átomo até o universo, tudo pode ser tratado a partir dessa ciência. Existem, por isso, muitas áreas de especialização, como a acústica, a astronomia, a física quântica e a nuclear. Por estudar essas leis e propriedades, a Física é capaz de compreender e mudar vários aspectos de nosso cotidiano, melhorando tecnologias, desenvolvendo materiais e explicando fenômenos naturais antes incompreendidos, fazendo assim, com que todos possam encontrar melhores soluções para o dia a dia.
O cursoComo a própria Física se abre em muitas áreas de atuação, na faculdade todas essas disciplinas são estudadas: Física Quântica, Termodinâmica, Ótica, Astronomia, Acústica e todas as partes que a ciência estuda. Além disso, a maioria dos currículos incluem disciplinas específicas de Cálculo e Química, para complementar o estudo dos jovens físicos. Se você optar pela licenciatura, também terá disciplinas voltadas à educação, como Didática e Sociologia da Educação, para aprender como lidar com o ambiente escolar e passar sua matéria da melhor forma possível aos seus alunos. E depois da formatura?Veja algumas das opções de carreira para quem se dedica aos estudos da Física: ProfessorDá aulas para alunos de Ensino Médio ou de cursos preparatórios. PesquisadorFaz pesquisas científicas em busca de novas descobertas na área, normalmente em ambiente acadêmico. A maioria dos pesquisadores também dá aulas em universidades. Física MédicaAperfeiçoa e cria equipamentos usados na indústria médica (o aparelho de raios-X, por exemplo). Física NuclearEstuda fenômenos nucleares, como radioatividade, fusão e fissão, em busca, principalmente, de novas fontes limpas de energia. AstrofísicaEstuda os planetas, galáxias, estrelas e os fenômenos que acontecem no espaço. Onde estudar?Universidade Federal do Rio Grande do Sul (UFRGS) – Porto Alegre, RS Universidade Federal de Santa Catarina (UFSC) – Florianópolis, SC Universidade Federal do Ceará (UFC) – Fortaleza, CE Universidade de Brasília (UNB) – Brasília, DF Universidade Federal de Minas Gerais (UFMG) – Belo Horizonte, MG Quer saber mais sobre o curso e a profissão? Confira esse vídeo produzido pelo Portal Futuro.Dicas do Blog do Enem:Dica 2 – O mais importante na hora de escolher uma carreira é estar bem informado sobre o curso e o mercado de trabalho! Confira o Guia de Profissões do Blog do Enem.Dica 3 – Confira algumas apostilas grátis que vão ajudá-lo na hora de estudar para o Enem e para os vestibulares.O post Física: curso, profissão e mercado de trabalho apareceu primeiro em Blog do Enem. |
| Ciências Atuariais: curso, profissão e mercado de trabalho Posted: 08 Dec 2015 05:01 PM PST Profissão: Você tem facilidade com Matemática e quer conhecer cursos que saem do óbvio? Que tal saber mais sobre o curso de graduação em Ciências Atuariais?A atuária é uma ciência que surgiu na Inglaterra, há cerca de 150 anos, para estudar a mortalidade e a expectativa de vida da população, com o objetivo de realizar previsões sobre valores de aposentadoria e pensão. O estudo destes cálculos foi muito aprofundado, e hoje eles são utilizados em qualquer situação que envolva a análise de risco. O atuário é um dos profissionais mais valorizados no mercado mundial, em especial em países como o Estados Unidos, onde se concentram as operações de grandes seguradoras e outras empresas que trabalham com a mensuração de riscos em áreas diversas. Dica 1: O maior segredo de um bom resultado nos estudos é ter um bom planejamento. Conheça nossas dicas para você planejar sua rotina de estudos.Dica 2: Gosta de cinema? Conheça 13 filmes que podem te ajudar no ENEM.
Quem é o atuário?O atuário é o profissional que tem conhecimento específico em cálculo de riscos e expectativas nas áreas da Saúde, das Finanças e da Economia. Sua base de conhecimento é desenvolvida através de teorias econômicas, de Administração, de Matemática e de estudos na área de demografia e de população. Esta capacidade de lidar com diferentes aspectos do cálculo de riscos e expectativas, torna o atuário um profissional com conhecimento multidisciplinar e muito importante para o mercado de trabalho atual. As características de um bom atuário envolvem conhecimento generalista, gosto por desafios, por cálculos, e uma capacidade de se manter atualizado com a realização de cursos e pós-graduações frequentes. A fluência em inglês é um diferencial importante para esse profissional, já que a grande maioria das empresas em que ele é requisitado é de origem americana ou inglesa, e boa parte de seu material de estudo avançado só está desenvolvido em inglês. O curso de graduação em Ciências AtuariaisO curso de graduação em Ciências Atuariais é desenvolvido em uma base Matemática muito sólida, por isso, suas disciplinas são todas derivadas de áreas como a Contabilidade, o cálculo numérico, a Economia, a Estatística e a Matemática Financeira. O estudo de populações também faz parte da grade deste curso, por isso é comum encontrar na grade das Ciências Atuariais disciplinas como a Demografia, a Previdência e outras voltadas para a área de humanas, aumentando a capacidade de atuação deste profissional. O último ano do curso de Atuária em universidades federais e privadas, exige que o aluno apresente um Trabalho de Conclusão de Curso (TCC), para que possa obter seu diploma de bacharel, e fazer a prova do Instituto Brasileiro de Atuária (IBA). Dica 3: Ter resultados ruins nas provas pode ser uma consequência de auto-sabotagem na hora dos estudos. Saiba evitar esta situação conferindo esse texto.Perfil do profissional após a formaçãoO profissional recém formado no curso de atuária trabalha bastante com cálculos, modelos e elaboração de planos de negócio, permitindo que ele adquira experiência e técnica, para que possa avançar na carreira. Depois disto ele pode migrar para tarefas mais elaboradas, como a coordenação de serviços de atuária, equipes e projetos maiores em grandes e pequenas empresas. Mercado de trabalho para Ciências AtuariaisO mercado para o profissional de atuária está bastante aquecido no momento. Como são poucas as universidades que oferecem este curso no país (14 no total, entre particulares e públicas), existem poucos profissionais para atuar nos vários locais que tem esta demanda. O atuário pode trabalhar na área de seguros, previdência privada ou pública, em bancos, auditorias, consultorias, corretoras e até em planos de saúde. A maior demanda para esse profissional é encontrada nas capitais dos vários estados brasileiros, com forte oferta de vagas em São Paulo, Brasília e Rio de Janeiro. É possível afirmar que a grande maioria dos recém formados aprovados na prova de título do IBA, tem oferta de emprego garantida. O salário inicial esperado para um recém formado é de R$2000,00, podendo chegar a até R$15.000,00, quando o profissional faz sua carreira em bancos, consultorias e auditorias. Ficou interessado em saber mais sobre a profissão de atuário e como é o mercado de trabalho para esse especialista? Confira aqui um vídeo produzido pela UFRGS sobre o curso e a atuação do aluno formado em Ciências Atuariais. Dica 4: Trabalha e estuda para o ENEM? Confira nossas dicas para se organizar melhor.O post Ciências Atuariais: curso, profissão e mercado de trabalho apareceu primeiro em Blog do Enem. |
| Fórmula Empírica e Molecular. Química Enem e Vestibular: Confira. Posted: 08 Dec 2015 12:34 PM PST Olá, o cálculo da fórmula mínima e molecular de uma substância, não é um assunto muito dominado pelos alunos que realizam as provas do Enem e dos vestibulares. Mas fique tranquilo, o blog do Enem não te deixa na mão!Nós preparamos um super-resumo para você, com videoaulas da Khan Academy e as explicações da professora Munique Dias. Não deixe essa chance passar! Acertar uma questão assim faz toda a diferença na sua nota final! A análise da composição de uma substância desconhecida nos permite determinar quais elementos (análise qualitativa) que constituem a molécula e em qual proporção os átomos se encontram (análise quantitativa) na mesma. É possível fazermos uma análise quantitativa de uma substância através da sua fórmula empírica e molecular.
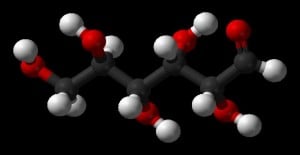
Mas o que é mesmo a fórmula molecular de uma substância? – A fórmula molecular nos indica o número de átomos de cada elemento que compõe a molécula ou espécie química da substância, bem como e proporção entre eles. Por exemplo: A molécula do peróxido de hidrogênio é formada por dois átomos de hidrogênio e dois átomos de oxigênio. Portanto e sua fórmula molecular é: H2O2 . Mas como é possível calcular a fórmula molecular de uma substância? Para a determinação da fórmula molecular é necessário primeiro obter a fórmula empírica dessa mesma substância. Ops! Fórmula empírica? Complicou agora? Que nada o blog do Enem esclarece para você.
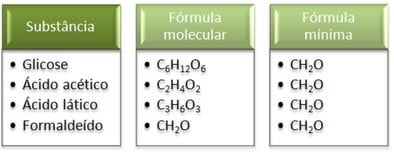
A fórmula empírica (ou mínima) indica a proporção, em menores números inteiros, entre os átomos dos elementos que formam as substâncias. Por exemplo: Na glicose (C6H12O6) a proporção dos átomos é de um átomo de carbono, para dois de hidrogênio, para um de oxigênio, ou seja, CH2O (1:2:1). É importante salientar que este tipo de fórmula não é suficiente para identificar uma substância. Há casos em que a fórmula mínima de uma substância corresponde à fórmula molecular de outra. E há substâncias que podem apresentar a mesma fórmula mínima. Confira neste quadro:
Veja que a fórmula mínima CH2O é a mesma para todas as substâncias, isto é, ela expressa que, em todos os casos, os átomos de carbono, hidrogênio e oxigênio estão presentes nas fórmulas moleculares em uma relação de 1:2:1. Além disso, o único que apresenta a fórmula molecular igual à fórmula empírica é o formaldeído. Complicou? Assista a vídeoaula do Biolugia e veja como calcular a fórmula mínima e molecular de uma substância, não fique para trás!
Dica 1 – Não lembra o que é fórmula percentua? Acesse o link: http://www.brasilescola.com/quimica/formula-percentual-ou-centesimal.htm e não fique com dúvidas!Quer ver exemplos ? Assista agora a uma super videoaula de exercícios e explicações da Khan Academy com o professor Salman Khan e fique fera! Determine a fórmula molecular de um óxido de fósforo que apresenta 43,6% de fósforo e 56,4% de oxigênio (porcentagem em massa) e massa molar 284 (massas atômicas: P = 31; O = 16). Resposta: P4O10 . Dica 2- Acesse os links: http://exercicios.brasilescola.com/quimica/exercicios-sobre-formula-minima-ou-empirica.htm#resposta-2652, http://exercicios.brasilescola.com/quimica/exercicios-sobre-formula-molecular.htm#resposta-2763 e faça vários exercícios sobre cálculo de fórmula empírica e fórmula molecular. Os textos e exemplos de apresentação desta aula foram preparados pela professora Munique Dias para o Blog do Enem. Munique é formada em química pela UFSC, tem mestrado e doutorado em Engenharia. Química, também pela UFSC. Facebook: https://www.facebook.com/MuniqueDias . O post Fórmula Empírica e Molecular. Química Enem e Vestibular: Confira. apareceu primeiro em Blog do Enem. |
| Transporte através da Membrana Plasmática- Biologia Celular Enem e vestibular Posted: 08 Dec 2015 05:00 AM PST Transporte Celular através da Membrana Plasmática é conteúdo essencial de Biologia para o vestibular e o Enem. Confira Osmose, Fagocitose, Bomba de Cálcio e Bomba de Potássio. 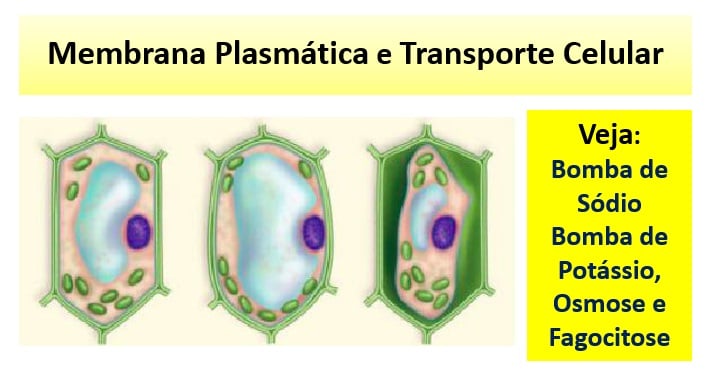 Transporte Celular e Membrana Plasmática A membrana celular é uma estrutura semipermeável, ou seja, com permeabilidade seletiva. Essa característica permite que a célula troque substâncias como o meio extracelular, como glicose, aminoácido, oxigênio, gás carbônico, amônia, sais minerais, água. Essa troca de substâncias é de fundamental importância para a célula, tendo em vista que ela absorve, produz, consome e elimina inúmeras substâncias em seu metabolismo. Se você está achando muito complicado este começo da revisão sobre Transporte de Substâncias a dica é dar uma paradinha e olhar agora mesmo esta aula especial sobre Parede Celular, Glicocálix, Membrana Plasmática e os Envoltórios Celulares: http://blogdoenem.com.br/envoltorios-celulares-biologia-enem-2/ O transporte que ocorre através da membrana pode ocorrer de duas formas: transporte passivo e transporte ativo. Transporte passivoEsse tipo de transporte ocorre sem gasto de energia (ATp). As moléculas são deslocadas sempre à favor do seu gradiente de concentração. Tipos: difusão simples, difusão facilitada, osmose. 1) Difusão simples – É a passagem de moléculas de soluto pequenas (oxigênio, gás carbônico, íons) do meio mais concentrado (hipertônico) para o meio menos concentrado (hipotônico).
Caso seja estabelecido a igualdade entre as concentrações, ocorre o equilíbrio dinâmico entre os dois meios, ou seja, para cada molécula que entra, outra sai. Ex: esse processo ocorre durante a hematose nos alvéolos pulmonares, onde o oxigênio entra no sangue e o gás carbônico sai do sangue para o pulmão. 2) Difusão facilitada – É a passagem de moléculas de soluto grandes (glicose, sais) do meio hipertônico para o meio hipotônico. Porém ocorre a participação de uma proteína presente na membrana chamada "permease". A permease tem função de enzima pois acelera o processo de passagem de solutos grandes. Esse processo não envolve gasto de energia. Exemplo: absorção da glicose pelas células do intestino delgado.
3) Osmose – É o deslocamento do solvente (água) do meio hipotônico para o meio hipertônico. Quando dois meios possuem a mesma concentração dizem que são isotônicos. Exemplo: Quando colocamos hemácias em meio hipertônico, a célula perde água ficando murcha (plasmolisada) (a). Quando a hemácia é colocada em um meio hipotônico, a célula recebe água ficando inchada (túrgida) (b). Caso continue entrando água, ocorre o rompimento da mesma chamado hemólise.
Quando esse experimento é feito com célula vegetal normal (1), no meio hipertônico, a membrana plasmática solta-se da parede celular pela perda de água, sofrendo plasmólise (3). Num meio hipertônico, a célula recebe água tornando-se túrgida (2). A presença da parede celular garante que a célula não se rompa.
Como consequência da osmose, quando entramos no mar ou na piscina, nosso corpo perde água para o meio que é hipertônico, e por isso murchamos. Quando temperamos salada de alface muito antes de consumi-las, notamos que as folhas murcham pois perdem água para o tempero (sal, vinagre).
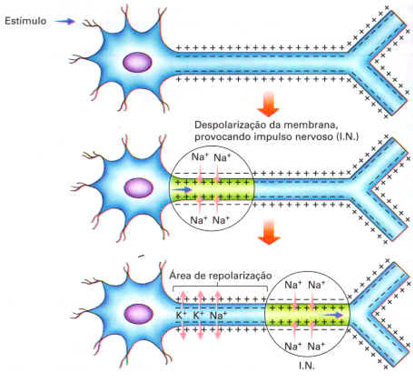
Transporte ativoO Transporte Ativo ocorre com o gasto de energia (ATp). As molécula são forçadas a movimentarem-se contra seus gradientes de concentrações. Exemplo: bomba de sódio (Na+) e potássio (K+). Bomba de sódio (Na+) e potássio (K+)A célula deve apresentar uma concentração de sódio (Na+) baixa dentro da célula, e alta fora. E a concentração do potássio (K+) é alta dentro da célula ,e baixa fora. Naturalmente, por difusão, o sódio (Na+) entra na célula, enquanto o potássio (K+) sai da célula. Para manter a diferença de concentração, a célula força a entrada do potássio (K+) e a saída do sódio (Na+). Como esses íons são forçados a ir do meio hipotônico para o hipertônico, ocorre gasto de energia. A proporção: saem 3 moléculas de sódio, entram 2 de potássio.
Essa diferença de concentração de sódio e potássio entre os meios intra e extracelular, permitem que a membrana fique polarizada. Ex: a polarização da membrana é utilizada pelos neurônios para conduzir o impulso nervoso, para controlar as atividades do corpo. A condução do impulso nervoso ocorre por um processo de despolarização de membrana. Em seguida a membrana é repolarizada com a bomba de sódio e potássio.
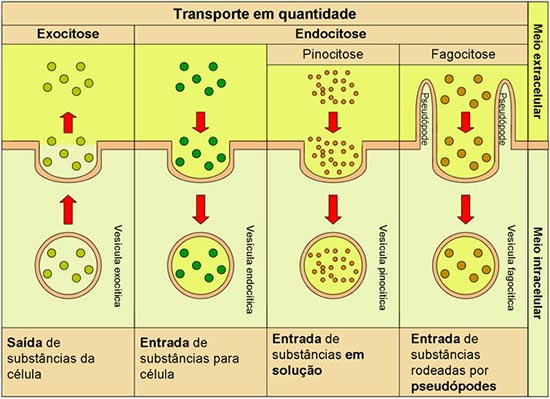
Dica 2 – As Mutações Genéticas são importantes para o processo de evolução dos seres vivos. Entenda como acontecem essas mutações nesta aula de Biologia Enem – http://blogdoenem.com.br/mutacoes-geneticas-aula-de-biologia-enem/ Dica 3 – Entenda como Darwinismo foi complementado com as descobertas dos genes no início do Séc. XX. Estude sobre Teoria Sintética nesta aula de Biologia Enem – http://blogdoenem.com.br/teoria-sintetica-biologia-enem/Transporte em blocoÉ o transporte de substâncias gigantes, e não é possível passar pelas estruturas da membrana. Então ocorre um processo de deformação da membrana para que essas substâncias sejam incorporadas ou eliminadas pelas célula. Esse processo consome energia, uma vez que envolve a produção de mais membrana plasmática e movimentos do citoesqueleto. ipos: endocitose e exocitose. Endocitose – É o englobamento de partículas para dentro da célula. Essas partículas serão digeridas pela células. Pode ser de duas formas: 1) Fagocitose: – englobamento de partículas sólidas; No interior da célula as partículas ficam envolvidas numa bolsa dita fagossomo. Ex: Esse processo pode ocorrer em protozoários com função de nutrição, como nas amebas, onde ocorre a formação de pseudópodos para a captura do alimento. As células de defesa do corpo, leucócitos, fazem fagocitose afim de englobar corpos estranhos como bactérias, protozoários, vírus, digerindo-os em seguida.
2) Pinocitose – englobamento de partículas líquidas ou dissolvidas em líquidos. Após o englobamento, ocorre a formação de uma vesícula com o conteúdo incorporado, chamado pinossomo. Exocitose (clasmocitose) – É a eliminação de substâncias pela célula. Essas substâncias podem ser resultado da digestão de partículas endocitadas, ou, substâncias produzidas pela própria célula (secreção) que serão expelidas. Ex: Após a digestão de um composto fagocitado, a ameba absorve substâncias úteis, e descarta substâncias tóxicas ou inúteis. Esse descarte é realizado por clasmocitose.
As células das glândulas sebáceas liberam sebo (lipídeo) por clasmocitose, de modo que atingem a superfície da pele. Esse sebo na pele confere impermeabilização e elasticidade à pele. Ocorre também exocitose quando os neurônios comunica-se entre si na sinapse nervosa. Ocorre a liberação de neurotransmissores na fenda sináptica por exocitose. Aula GratuitaSaiba mais sobre Transporte através da membrana plasmática nesta aula do canal Biolugia, disponível no Youtube. Após assistir, revise o que você aprendeu respondendo aos nossos desafios!
|
| Química: Revisão de Cálculo Estequiométrico para vestibular e Enem Posted: 08 Dec 2015 03:00 AM PST Os cálculos estequiométricos correspondem aos cálculos de massa, de quantidade, de matéria e, em alguns casos, de volume das substâncias envolvidas em uma reação química, que são feitos com base na proporção entre os coeficientes estequiométricos da reação (proporção estequiométrica). Confira! A primeira pergunta na sua cabeça quando encontra uma questão de balanceamento de reações químicas é esta: Mas o que eu preciso saber para poder resolver questões sobre cálculo estequiométrico?  cálculo Estequiométrico Para você fazer o cálculo estequiométrico de uma reação é necessário conhecer a proporção entre os coeficientes estequiométricos de reação, e isso é possível através do balanceamento das equações químicas. BALANCEMANTO QUÍMICO DAS EQUAÇÕES QUÍMICAS – Vamos a um exemplo bem explicado para você nunca mais errar uma questão de balanceamento químico! Exercício para você entender Cálculo Estequiométrico. Suponha a seguinte reação: Ca (OH)2(aq) + Al2(SO4)(aq) →Al(OH)3(s) + CaSO4(s) O processo de balanceamento pode ser feito de muitas maneiras, sendo o método das tentativas o mais utilizado. Esse método consiste em:
Acompanhe a resolução – Veja:No caso da reação dada existem duas espécies que aparecem apenas uma vez em cada lado da equação, o Alumínio (Al) e o Cálcio (Ca), portanto, vamos dar preferência ao elemento que possui maior índice que é o alumínio. Ca(OH)2(aq) + Al2(SO4)(aq) → 2Al(OH)3(s) + CaSO4(s)
1Ca(OH)2(aq) + Al2(SO4)(aq) → 2Al(OH)3(s) + CaSO4(s) Agora contamos o número dos hidrogênios, que são 2 hidrogênios do lado direito e 6 hidrogênios do lado esquerdo da equação, então é preciso igualar os hidrogênio do lado esquerdo colocando o número 3 na frente da espécie : Ca(OH)2(aq) para que possamos ter o mesmo número de hidrogênios do outro lado da equação. Assim: 3Ca(OH)2(aq) + Al2(SO4)(aq) → 2Al(OH)3(s) + CaSO4(s) Ops! Agora o número de átomos de cálcio não é o mesmo nos dois lados da equação. Então é preciso balancear o átomo de cálcio, colocando o número 2 na frente da espécie: CaSO4(s) 2Ca(OH)2(aq) + Al2(SO4)(aq) → 2Al(OH)3(s) + 3CaSO4(s) OBS: Por isso o método é chamado de tentativa, pois se deve ir ajustando os coeficientes estequiométricos até conseguir o balanceamento total da equação.
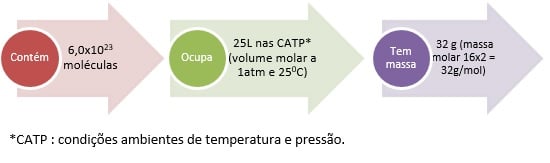
Então a equação final balanceada é: 2Ca(OH)2(aq) + Al2(SO4)(aq) → 2Al(OH)3(s) + 3CaSO4(s) Dica 1 – Já que você precisa relembrar mais sobre o balanceamento químico, o blog do Enem preparou um super-resumo com dicas da professora Munique Dias e videoaulas da Khan Academy para você! Acesse esta aula gratuita e nunca mais esqueça: http://blogdoenem.com.br/quimica-enem-khan-academy/ .Agora que já sabemos como balancear uma equação, vamos revisar como fazer o cálculo estequiométrico? CÁLCULO ESTEQUIOMÉTRICOA quantidade de uma substância, em mol, também pode ser expressa em outras grandezas e, portanto, em outras unidades como: 1 mol = 6,0×1023 moléculas = No estado gasoso 25L (volume molar, a 1 atm a 25oC). Não esqueça! Sempre serão esses valores para mol e volume, porém a massa em gramas dependerá da fórmula de cada substância. Por exemplo: 1 mol de O2:
Dicas para você ver muito mais sobre cálculos estequiométricos?Dica 2 – O blog do Enem não te deixa na mão! Acesse uma aula completa com vídeos Khan Academy, vídeo dos professores do Kuadro, aula da professora Munique Dias, e aprenda de vez como fazer cálculos estequiométricos: http://blogdoenem.com.br/quimica-enem-revisao/ Veja esta aula, faça os exercícios e vamos lá. É para gabaritar a prova de química da FUVEST, de vestibulares ou do Enem!!Dica 3 – Prepare-se para o vestibular resolvendo questões da Fuvest, Unicamp, Unesp e Enem. Acesse o site http://guiadoestudante.abril.com.br/estudar/jogos-multimidia/revisao-para-vestibular-647127.shtml.Nele você pode montar a sua própria prova,colocando as matérias que mais tem dificuldade e testando o tempo que demora para resolver cada questão.TIPOS DE FÓRMULAS para Cálculo Estequiométrico Nós do blog do Enem, separamos para você uma serie de videoaulas para você revisar alguns conteúdos que fazem parte dos cálculos estequiométricos que são: Fórmula porcentual ou composição centesimal. Veja aqui nesta videoaula com o pessoal do Kuadro: Quer ver outras aulas da Khan Academy? Veja aqui os vídeos da Khan Academy já traduzidos para o Português pela equipe da Fundação Lemann http://www.fundacaolemann.org.br/khanportugues/#videosÉ isso ai ? Gostou? Agora é só mandar ver nas provas do Enem, dos vestibulares, e da FUVEST! "Um passo à frente e você não está mais no mesmo lugar." (Um passeio no mundo livre – Chico Science & Nação Zumbi)  Os textos e exemplos de apresentação desta aulasobre Cálculo Estequiométrico foram preparados pela professora Munique Dias para o Blog do Enem. Munique é formada em química pela UFSC, tem mestrado e atualmente cursa o doutorado em Engenharia. Química, também pela UFSC. Facebook: https://www.facebook.com/MuniqueDias . O post Química: Revisão de Cálculo Estequiométrico para vestibular e Enem apareceu primeiro em Blog do Enem. |
| You are subscribed to email updates from Blog do Enem. To stop receiving these emails, you may unsubscribe now. | Email delivery powered by Google |
| Google Inc., 1600 Amphitheatre Parkway, Mountain View, CA 94043, United States | |















0 comentários:
Postar um comentário